

É a parte da Química que faz o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições e quais os mecanismos de desenvolvimento de uma reação. Para isso devemos também criar outros conceitos que serão necessários no nosso estudo. Vejamos:
Velocidade de uma reação química: é a relação entre a quantidade consumida ou produzida e o intervalo de tempo gasto para que isso ocorra.
Imagine uma reação genérica A + B à C + D. Podemos calcular a velocidade de desaparecimento de qualquer reagente (A ou B) ou então a velocidade de aparecimento de qualquer produto (C ou D).

Utiliza-se o módulo para evitar valores negativos de velocidade, o que ocorreria no caso dos reagentes, para os quais a quantidade final é menor que a inicial.
Essas quantidades são normalmente expressa em mols.
A medida do tempo é também expressa em qualquer unidade que se ajuste à determinada reação.
Chamamos essa velocidade de velocidade média (Vm). A quantidade da substância pode ser expressa em:
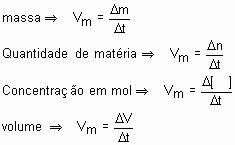
Antes que uma reação tenha início, a quantidade de reagentes é máxima e a quantidade de produtos é zero. A medida que a reação se desenvolve, os reagentes vão sendo consumidos e, portanto, a quantidade de reagentes vai diminuindo até se tornar mínima (ou eventualmente zero). Ao mesmo tempo, os produtos vão sendo formados. Logo, a quantidade de produtos, que no início é baixa, começa a aumentar até que, no final da reação, se torna máxima.
Expressando esse fato em um gráfico da concentração em quantidade de matéria de reagentes e produtos, em função do tempo, veremos que apresentam certas características. Observe:
|
Gráfico de reagentes |
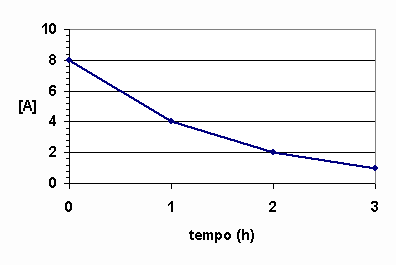
A curva decrescente indica que o reagente A é consumido com o passar do tempo.
|
Gráfico de produtos |
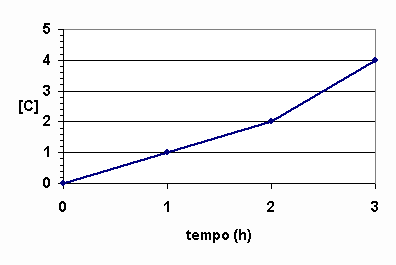
A curva crescente indica que o produto C é produzido com o passar do tempo.
Analisemos, então, o que ocorre com a reação C2H2 + 2H2 à C2H6. Um químico, medindo a quantidade de matéria de etano (C2H6) em função do tempo e nas condições em que a reação se processa, obteve os seguintes resultados:
|
Tempo (min) |
Quantidade de matéria (em mols) de etano formada |
|
0 |
0 |
|
4 |
12 |
|
6 |
15 |
|
10 |
20 |
Teríamos então o gráfico da quantidade de matéria de etano em função do tempo.
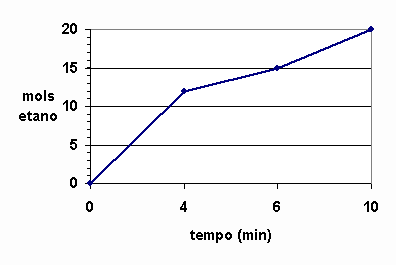
Poderíamos também calcular a velocidade média dessa reação em qualquer intervalo de tempo:
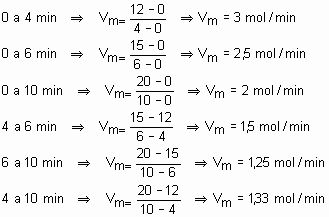
Analisando o primeiro resultado (3 mol/min): A cada minuto formam-se, em média, 3 mols de moléculas de etano.
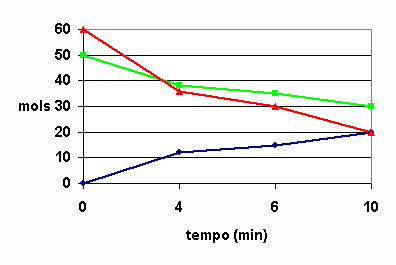
Imagine agora que tenhamos os valores dos reagentes e a seguinte tabela:
|
Tempo (min) |
Quantidade de matéria (em mols) de C2H2 consumida |
Quantidade de matéria (em mols) de H2 consumida |
Quantidade de matéria (em mols) de etano formada |
|
0 |
50 |
60 |
0 |
|
4 |
38 |
36 |
12 |
|
6 |
35 |
30 |
15 |
|
10 |
30 |
20 |
20 |
Teríamos então o gráfico da reação em quantidade de matéria de etano em função do tempo.
Se calcularmos a velocidade média da reação em função de C2H2, nos intervalos, teremos:
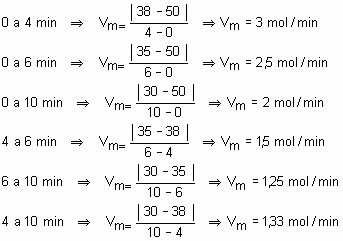
Encontramos os mesmos resultados do etano e, caso não utilizássemos o módulo, teríamos resultados negativos, o que seria justificado em função de estar sendo consumido (reagente).
Se calcularmos a velocidade média da reação em função de H2, nos intervalos, teremos:
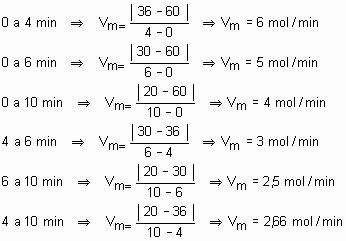
Note que os resultados foram o dobro dos valores encontrados no C2H2 e no C2H6, porque, observando a equação, percebemos que a proporção estequiométrica entre esses dois reagentes é 1:2. Se dividirmos as velocidades médias de consumo ou formação pelos respectivos coeficientes, teremos sempre o mesmo valor, que é a velocidade média da reação.
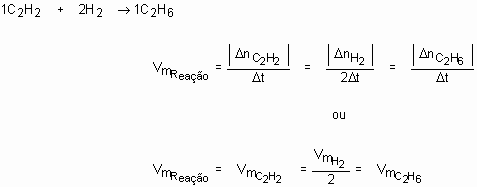
Dessa forma, podemos criar o seguinte raciocínio, para uma reação genérica:
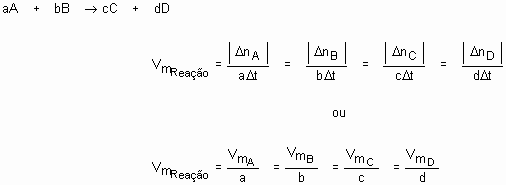
Velocidade instantânea: é o limite para o qual tende a velocidade média, quando os intervalos de tempo vão se tornando cada vez menores, ou seja, a variação do tempo (D t) tende a zero.
![]()
Considere a reação entre zinco com ácido clorídrico formando cloreto de Zinco e liberando gás hidrogênio, conforme a reação: Zn + HCl à ZnCl2 + H2.
A medida que decorre o tempo, a concentração de ácido clorídrico vai diminuindo conforme o gráfico a seguir:
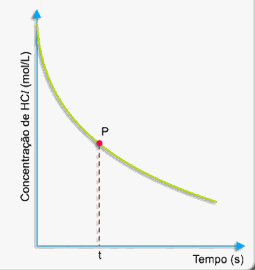
Como calcular a rapidez (velocidade) da reação nesse instante (tempo t)?
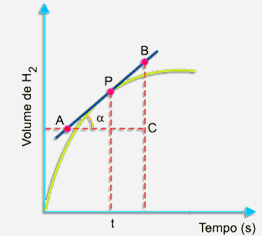
Primeiramente, trace uma tangente à curva pelo ponto P, conforme o desenho a seguir:
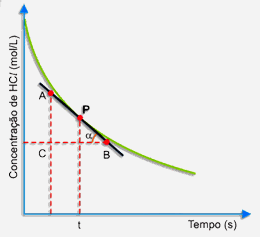
Escolha, sobre a tangente, dois pontos A e B. No triângulo retângulo ABC, a tangente trigonométrica do ângulo a é dado por:
![]()
A tangente do ângulo a (inclinação da curva) expressa a velocidade da reação no instante t.
O volume de gás hidrogênio formado aumenta com o passar do tempo. A velocidade no instante t em termos de variação do volume de gás hidrogênio formado com o tempo pode ser calculado pelo mesmo processo. Veja a figura:
![]()
Veja a aplicação dessa teoria em um exercício da Fuvest-SP
O 2-bromobutano (líquido) reage com hidróxido de potássio (em solução de água e álcool) formando o 2-buteno (gasoso) e, em menor proporção, o 1-buteno (gasoso):
C4H9Br + KOH à C4H8 + KBr + H2O.
Numa experiência, 137g de 2-bromobuteno e excesso de KOH foram aquecidos a 80O C. A cada 50s o volume da mistura de buteno foi determinado, nas condições ambientais, obtendo-se o gráfico a seguir:
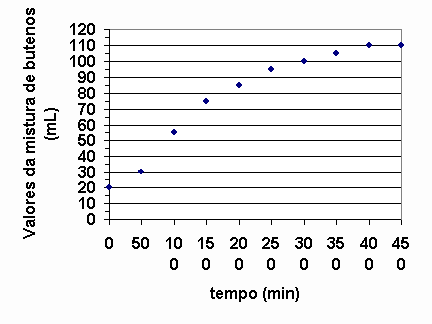
Observando-se o gráfico acima, o que se pode afirmar sobre a velocidade da reação quando se comparam seus volumes médios ao redor de 100, 250 e 400 segundos? Justifique utilizando o gráfico.
Resolução: Podemos determinar a velocidade instantânea nos instantes solicitados, ou seja, 100, 250 e 400s através do ângulo de inclinação da tangente da curva em cada ponto.
Aproximadamente, calculemos a velocidade da reação ao redor dos valores solicitados:
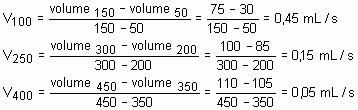
A medida que decorre o tempo, a velocidade da reação diminui.
|
Exercícios Resolvidos |
§
(FEI-SP) Seja a decomposição de água oxigenada: 2H2O2 à 2H2O + O2.Em dois minutos, observa-se uma perda de 3,4g de água oxigenada. Qual a velocidade média dessa reação em relação ao gás oxigênio em mol/min?
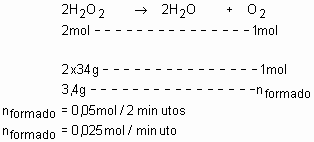
§
(E.E.Mauá-SP) A concentração [A], expressa em mol/L de uma substância A que, em meio homogêneo, reage com outra B, segundo a equação A + B à C + D, varia com o tempo t segundo a lei: [A]= 5 – 0,2t – 0,1t2, com t medido em horas. Qual a velocidade média dessa reação entre os instantes t1 = 1h e t2 = 2h?
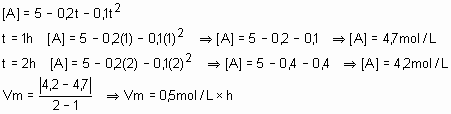
§
(Unificado Cesgranrio) Numa experiência envolvendo o processo: N2 + 3H2 à 2NH3, a velocidade da reação foi expressa comoConsiderando a não-ocorrência de reações secundárias, qual a expressão dessa mesma velocidade, em termos de concentração de gás hidrogênio?
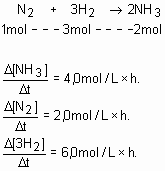
§
A figura abaixo indica a variação da quantidade de reagente em função do tempo (t), num sistema em reação química. Calcule a velocidade dessa reação nos intervalos de tempo:a)de 0 a 2min;
b)de 2 a 4min;

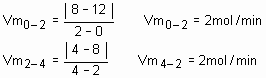
§
(PUC-SP) Na reação de solução de ácido clorídrico com zinco metálico, o gráfico que melhor representa o comportamento das espécies em solução é:
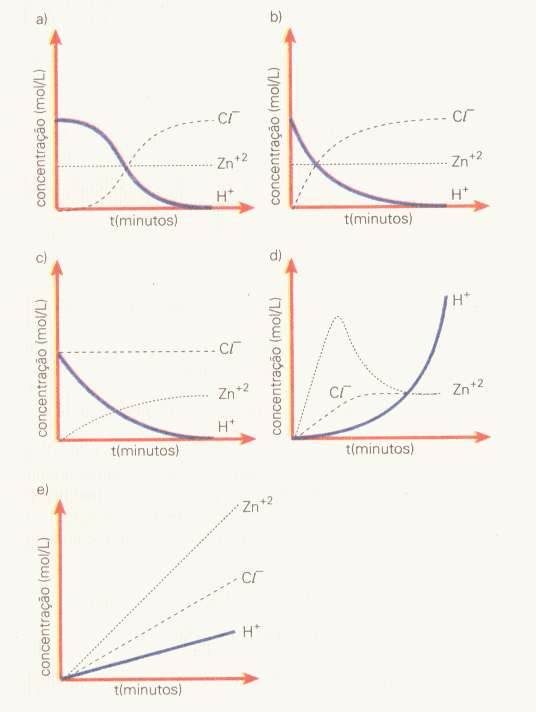
§
(Faap-SP) A reação de decomposição de iodidreto é representada pela equação química2HI ß à I2 + H2
O controle da concentração de iodidreto presente no sistema, em função do tempo (em temperatura constante) forneceu os seguintes dados:
|
Iodidreto(mol/L) |
1 |
0,625 |
0,375 |
0,200 |
0,120 |
|
Tempo (min) |
0 |
10 |
20 |
30 |
40 |
A velocidade dessa reação é constante? Por que?
Resposta: Não, a velocidade diminui com o tempo – basta verificar na tabela que, à medida que o tempo passa, a variação da concentração do iodidreto vai se tornando cada vez menor.
§
(UFPR) Apesar da dissolução da areia (SiO2) em água ser um processo espontâneo, ela jamais foi observada por qualquer ser humano. Discuta essa afirmativa em termos de termodinâmica e cinética do processo.Resposta: Dizer que a dissolução da areia é espontânea é dizer que ela é termodinamicamente possível (D G<0), mas se a reação nunca foi observada é porque sua velocidade deve ser tão baixa que levará muitos séculos para se realizar
§
(UFC-CE) O tempo de validade de um alimento em suas características organolépticas e nutricionais depende da embalagem e das condições ambientais. Um dos tipos de acondicionamento necessário para a conservação de alimentos e a folha-de-flandres, constituída de uma liga de estanho e aço. Analise o gráfico abaixo, que representa a reação de oxidação entre a embalagem e o meio agressivo e responda: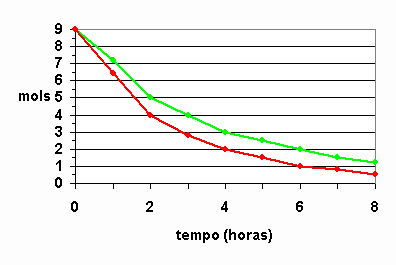
a)Em qual das curvas, verde ou vermelha, a velocidade da reação química é mais acentuada?
Resposta: Curva vermelha, pois considerando que as duas saíram com o mesmo número de mols, ou seja, 9 mols e a vermelha terminou com uma quantidade menor que a verde. Daí, dá para calcular a velocidade média da reação global, que seria a vermelha maior que 1 e a verde, menor que 1. Para confirmar, basta jogar na fórmula da velocidade média. Veja só:
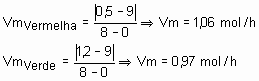
b)Considerando a área da folha-de-flandres constante, calcule a velocidade média da reação química no intervalo entre duas e 4 horas para a curva de maior corrosão.
Resposta: 1g/h
(Mack-SP) A combustão do butano é representada pela equação:§
![]()
Se houver um consumo de 4 mols de butano a cada 20 minutos de reação, qual o número de mols de dióxido de carbono produzido em uma hora?
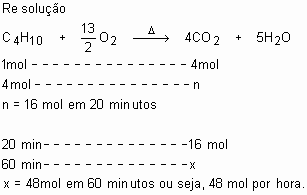
|
Exercícios propostos |
1. Considere a reação CaCO3 à CaO + CO2. Foi aquecida uma certa massa de carbonato de cálcio e o volume de gás carbônico obtido foi sendo observado e medido em função do tempo. Foi obtida a tabela abaixo:
|
Mols de CO2 |
Tempo (min) |
|
0 |
0 |
|
20 |
10 |
|
35 |
20 |
|
45 |
30 |
|
50 |
40 |
|
52 |
50 |
a)Qual a velocidade média dessa reação no intervalo de 0 a 10 min?
b)Calcule a velocidade média dessa reação nos demais intervalos.
Resposta:
a)2 mol/min
b)Vm10-20= 1,5 mol/min; Vm20-30= 1,0 mol/min; Vm30-40= 0,5 mol/min; Vm40-50= 0,2 mol/min.
2. Dada a reação 2SO2 + O2 à 2SO3, calcule a velocidade em relação a cada participante e a velocidade média, conforme a tabela, nos seguintes casos:
|
Tempo (s) |
Quantidade de matéria (em mols) de SO2 existente |
Quantidade de matéria (em mols) de O2 existente |
Quantidade de matéria (em mols) de SO3 existente |
|
0 |
6,0 |
4,0 |
0,0 |
|
2 |
5,0 |
3,5 |
1,0 |
|
6 |
2,2 |
2,1 |
3,8 |
|
12 |
1,0 |
1,5 |
5,0 |
a) De 0s a 2s
b) De 2s a 6s
c) De 6s a 12s
d) De 2s a 12s
Respostas
a)V SO2= 0,5; V O2= 0,25; V SO3= 0,5; Vm=0,25
b)V SO2= 0,7; V O2= 0,35; V SO3= 0,7; Vm=0,35
c)V SO2= 0,2; V O2= 0,10; V SO3= 0,2; Vm=0,10
d)V SO2= 0,4; V O2= 0,20; V SO3= 0,4; Vm=0,20
3. Na reação 2H2O2 à 2H2O + O2, a velocidade média dessa reação num certo intervalo de tempo, é 8 mol/s em relação a água oxigenada. Qual a velocidade em relação ao oxigênio no mesmo intervalo de tempo?
Resposta: 4 mol/s
4. Realizou-se a reação de decomposição do ácido carbônico: H2CO3 à H2O + CO2. Mediu a concentração em quantidade de matéria de gás carbônico nos tempos 10s e 20s e obteve o seguinte resultado em mol/L:
10s : 0,2 M
20s : 0,8 M
Qual a velocidade média dessa reação no intervalo de 10s a 20s?
Resposta: 0,06M
5. Dada a tabela abaixo em relação à reação 2HBr à H2 + Br2 :
|
Tempo (min) |
Mols de HBr |
|
0 |
0,200 |
|
5 |
0,175 |
|
10 |
0,070 |
|
15 |
0,040 |
|
20 |
0,024 |
a) Qual a velocidade média desta reação em relação ao HBr, no intervalo de 0 a 5 minutos?
b) Qual a velocidade média dessa reação, no intervalo citado anteriormente, em relação ao gás hidrogênio?
c) Determine a velocidade média dessa reação para o HBr e para o Br2, no intervalo de 10 a 15 min.
Resposta:
a)0,005
b)0,0025
c)0,006 (HBr) e 0,003 (Br2)
6. Foi misturado 2 mols de gás hidrogênio com 3 mols de gás cloro num recipiente fechado. Suponha que do início da mistura até 15s, a reação H2 + Cl2 à 2HCl ocorra conforme os dados da tabela.
|
Tempo (s) |
Quantidade de matéria (em mols) de H2 existente |
Quantidade de matéria (em mols) de Cl2 existente |
Quantidade de matéria (em mols) de HCl existente |
|
0 |
2,0 |
3,0 |
0 |
|
1 |
1,75 |
2,75 |
0,5 |
|
3 |
1,5 |
2,5 |
1,0 |
|
6 |
1,25 |
2,25 |
1,5 |
|
10 |
1,0 |
2,0 |
2,0 |
|
15 |
0,75 |
1,75 |
2,5 |
a) Calcule a velocidade em relação a cada participante e a velocidade média da reação no intervalo de 10 a 15s.
b) Usando papel milimetrado, construa no mesmo sistema de coordenadas o gráfico que mostra a variação da quantidade existente (em mol) de cada participante em função do tempo. Represente a quantidade em mol na ordenada e o tempo na abcissa.
Respostas:
a) V H2= 0,025; V Cl2= 0,025; V HCl= 0,05; Vm=0,025 mol/s
b)
7. (Unicamp-SP) Amostras de magnésio foram colocadas em soluções de ácido clorídrico a diversas concentrações e temperaturas havendo total "dissolução" do metal e desprendimento de gás hidrogênio . Observaram-se os seguintes resultados:
|
Amostra |
Massa de magnésio "dissolvida" |
Tempo para dissolver |
|
I |
2,0g |
10 min |
|
II |
0,40g |
2,0 min |
|
III |
0,40g |
1,0 min |
|
IV |
0,50g |
1,0 min |
a) Em qual caso a velocidade média da reação foi maior?
b) Em qual caso desprendeu-se maior quantidade de hidrogênio?
Respostas:
a) V I= 0,2g/min; V Il= 0,2g/min; V lII= 0,4g/min; V IV=0,5g/min. A velocidade maior é 0,5g/min, ou seja, a amostra IV.
b)Quanto maior a massa de magnésio consumida, maior a quantidade de hidrogênio desprendida. Então, a amostra IV desprende mais hidrogênio.
8. (PUC-PR) A revelação de uma imagem fotográfica em um filme é um processo controlado pela cinética química da redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de determinado filme usando um revelador D-76.
|
Quantidade existente do revelador (mol) |
Tempo de revelação (min) |
|
24 |
6 |
|
22 |
7 |
|
21 |
8 |
|
20 |
9 |
|
18 |
10 |
A velocidade média de revelação no intervalo de tempo de 7 min a 10 min é, em mol/min:
a) 3,14
b) 2,62
c) 1,80
d) 1,33
e) 0,70
Resposta: d
9. (UFPE) Considere a reação: 2N2O à 4NO2 + O2. Admita que a formação de gás oxigênio tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO2 formada em 1 min é:
a) 96g
b) 55,2g
c) 12g
d) 552g
e) 5,52g
Resposta: d
10. (PUC-MG) A poluição pelo NO2 é uma das causas de destruição da camada de ozônio. Uma das reações que pode ocorrer no ar poluído é a reação do dióxido de nitrogênio com o ozônio: 2NO2 + O3 ß à N2O5 + O2. Admita que a formação do O2 tem uma velocidade média constante igual a 0,05 mol.L /s. A massa de ozônio consumida em 1 min é, em gramas:
a) 2,40
b) 144
c) 1,60
d) 96
e) 48
Resposta: b
11. (UFPE) O gráfico a seguir representa a variação de concentração das espécies A, B e C com o tempo. Qual das alternativas a seguir contém a equação química que melhor descreve a reação representada pelo gráfico?
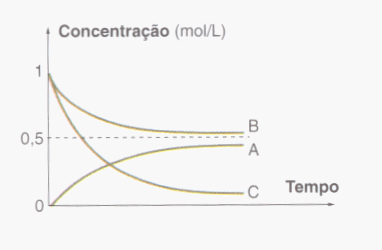
a) 2A + B à C
b) A à 2B + C
c) B + 2C à A
d) 2B + C à A
e) B + C à A
Resposta: C
12. (PUC-MG) Considere a equação: 2NO2 + 4CO à N2 + 4CO2. Admita que a formação do gás nitrogênio tem uma velocidade média constante igual a 0,05 mol/L.min. Qual a massa, em gramas, de gás carbônico formada em uma hora?
Resposta: 528g
13. (Mack-SP) Numa certa experiência, a síntese do cloreto de hidrogênio ocorre com o consumo de 3 mols de gás hidrogênio por minuto. Qual a velocidade de formação do cloreto de hidrogênio?
Resposta: 6 mol/min.
14. (FEI-SP) Um prego de ferro, em presença de umidade, reage com o oxigênio do ar produzindo óxido de ferro III hidratado e liberando hidrogênio. A reação acontece até consumir todo o prego. Dos gráficos abaixo, o que melhor representa a velocidade (v) dessa reação em função do tempo (t) é:
|
|
|
|
|
Resposta: a
15. (Faap-SP) Num dado meio onde ocorre a reação N2O5 à N2O4 + ½ O2, observou-se a seguinte variação na concentração de N2O5 em função do tempo:
|
N2O5 (mol/L) |
0,233 |
0,200 |
0,180 |
0,165 |
0,155 |
|
Tempo (s) |
0 |
180 |
300 |
540 |
840 |
Calcule a velocidade média da reação no intervalo de 3 a 5 min.
Resposta: 0,01 mol/L.min
16. (Fesp-SP) A reação de decomposição do amoníaco (NH3) produz 8,40g/min de gás nitrogênio. Qual a velocidade dessa reação em mols de NH3 por hora?
Resposta: 36 mol/h
17. (Unisinos-RS) A combustão completa do etanol ocorre pela equação:
C2H5OH + 3 O2 à 2CO2 + 3H2O
Considerando que em uma hora foram produzidos 2640g de gás carbônico, qual a velocidade da reação , expressa em número de mols de etanol consumidos por minuto?
Resposta: 0,5
18. (Fuvest-SP) Para uma dada reação química, expressa como A à B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
Resposta: 90 min.
19. (UESC) A água oxigenada – H2O2 – se decompõe, produzindo água e gás oxigênio, de acordo com a equação: H2O2 à H2O + ½ O2. O gráfico abaixo foi construído a partir de dados experimentais e mostra a variação da concentração de água oxigenada em função do tempo.
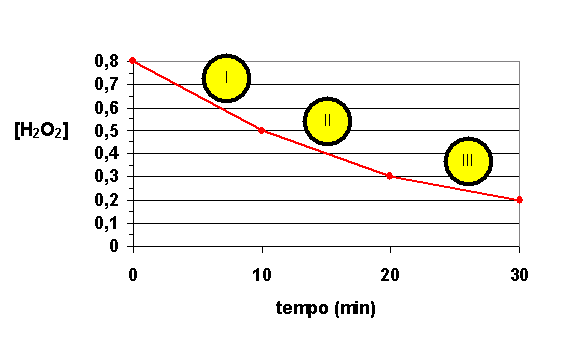
Qual será a velocidade média de decomposição da água oxigenada nos intervalos I, II e III?
Resposta: 0,03 M/min; 0,02 M/min e 0,01 M/min
|
Condições para que uma reação ocorra |
As condições fundamentais para que uma reação ocorra são afinidade química e contato entre os reagentes.
As substâncias colocadas para reagir devem possuir tendência para entrar em reação.
As interações químicas são devidas às colisões entre as partículas dos reagentes.
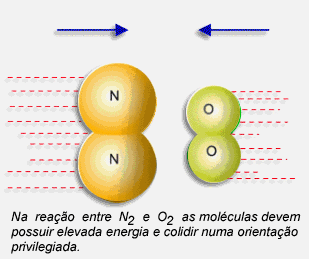
Deve haver choque entre partículas ativadas energeticamente e ocorrer uma boa orientação na colisão. Dessa forma podemos explicar quando uma reação, termodinamicamente possível, é lenta ou rápida, ou seja, comparar as suas velocidades.
|
Teoria das colisões |
Partimos do princípio de que as partículas de uma substância química não estão paradas. Elas possuem uma determinada quantidade de energia e se movimentam.
Este movimento faz com que se choquem.
Este choque pode fazer com que ocorra a reação.
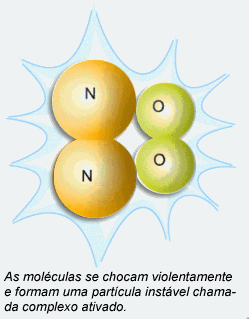
Energia de ativação: é o valor mínimo de energia que as moléculas dos reagentes devem possuir para que uma colisão entre elas seja eficaz. Quanto maior for a energia de ativação, mais lenta será a reação.
Choques mal orientados, mesmo entre partículas ativadas, não conduzem à reação, assim como choques bem orientados entre partículas não ativadas também não conduzem. Dessa forma, o choque deve ocorrer entre partículas ativadas em uma boa orientação.

|
Análise gráfica da energia de ativação |
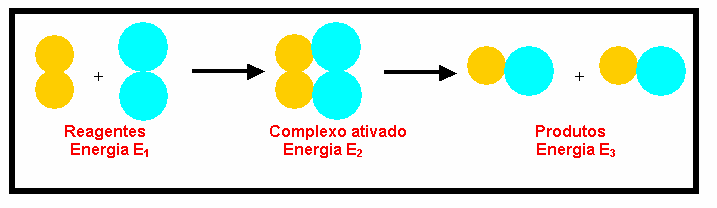
Reação exotérmica: A entalpia dos produtos é menor que a dos reagentes, ou seja, apresenta D H<0. Pode ser representada de várias formas:
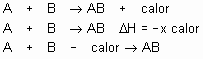
Veja que o sinal do D H é igual ao calor do primeiro membro e contrário ao do segundo membro, quando vem na própria reação.
|
|
E1= energia dos reagentes (r) E2= energia do complexo ativado (CA) E3= energia dos produtos (p) b=energia de ativação da reação direta c=variação de entalpia (D H= Hp – Hr)
|
Reação endotérmica
: A entalpia dos produtos é maior que a dos reagentes, ou seja, apresenta D H>0. Pode ser representada de várias formas:
Veja que o sinal do D H é igual ao calor do primeiro membro e contrário ao do segundo membro, quando vem na própria reação.
|
|
E1= energia dos reagentes (r) E2= energia do complexo ativado (CA) E3= energia dos produtos (p) b=energia de ativação da reação direta c=variação de entalpia (D H= Hp – Hr)
|
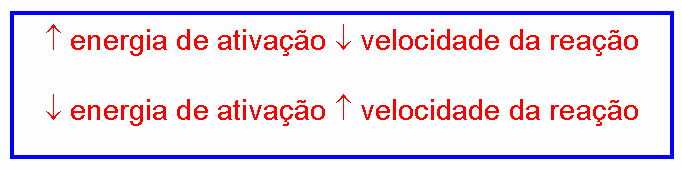
A energia de ativação deve ser entendida como uma dificuldade para ocorrer a reação. Dessa forma, quanto maior for a energia de ativação, mais difícil será para a reação acontecer. São reações que necessitam que se forneça muita energia para que ocorram: são reações lentas.
Quanto menor a energia de ativação, mais fácil será para a reação acontecer. São reações que necessitam de pouca energia para que ocorram: são reações rápidas.
|
Exercícios resolvidos |
Indique os números que representam a variação de entalpia e a energia de ativação da reação direta.§
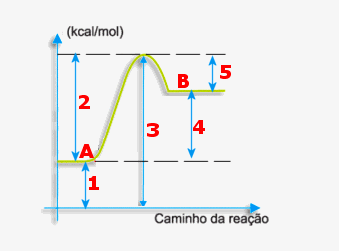
Resposta: Reação direta é a reação da esquerda para a direita. Dessa forma, A é o reagente e B é o produto. A energia de ativação da reação direta é o 2 e variação de entalpia, o 4.
§
Considerando o gráfico, responda os números que correspondem a variação de entalpia e a energia de ativação da reação inversa.
Resposta: Reação inversa é a reação da direita para a esquerda. Dessa forma, o B é o reagente e o A é o produto. O 5 é a energia de ativação da reação inversa e a variação de entalpia é representada pelo 4.
§
Considere os seguintes processos: neutralização de leite de magnésia no estômago, oxidação de cobre, formando zinabre e ataque de ácido muriático (HCl) em pedaço de palha de aço. Quem apresenta alta energia de ativação?Resposta: Ter alta energia de ativação significa velocidade baixa, ou seja, reação muito lenta. Isso quer dizer que somente a oxidação do cobre formando zinabre apresenta, pois é uma reação lenta. Já os dois outros processos apresentam energia de ativação baixa, o que significa uma reação rápida.
§
A combustão do gás de cozinha é uma reação exotérmica, porém só se inicia ao receber energia externa como, por exemplo, a da chama de um palito de fósforo. Como é chamada a energia fornecida pelo palito?Resposta: A energia fornecida pelo palito é aquela necessária para iniciar a reação. Recebe o nome de energia de ativação.
§
Observe o diagrama de energia e julgue as afirmativas:|
I- O processo é exotérmico; II- A reação tem variação de entalpia igual a –30 kcal III- A energia de ativação vale +130 kcal IV- O valor do complexo ativado é +90 kcal
Resposta: I-F O processo é endotérmico, pois a energia dos produtos (40) é maior que a dos reagentes (10); II-F A variação de entalpia é de +30 kcal, ou seja, 40-10; III-F A energia de ativação é 80 kcal, pois inicia em 10 kcal (entalpia dos reagentes) e vai até 90 kcal (complexo ativado); IV-V O complexo ativado é o ápice da curvatura do gráfico (90 kcal) |
§
Considere o gráfico da reação e responda os quesitos a seguir:
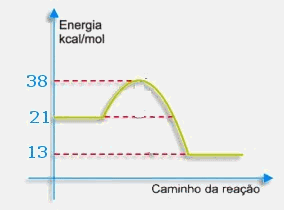
a)Qual a energia das moléculas reagentes e a das moléculas dos produtos?
R: A entalpia dos reagentes é 21 kcal e a dos produtos é 13 kcal. Na reação direta, sempre quem está encostado no eixo é o reagente.
b)Qual a energia de ativação?
R: Ela inicia na entalpia dos reagentes e vai até o ápice da curvatura (complexo ativado). Nesse caso, ela vai de 21 a 38, o que indica que é +17 kcal.
c)Qual o tipo da reação em questão? Por quê?
R: O tipo da reação depende da variação de entalpia, que é calculada pela entalpia dos produtos menos a entalpia dos reagentes (D H=Hp-Hr). Nesse caso, ela é exotérmica, pois terá como resultado, o valor de –8 kcal. Isso indica que ela liberou energia, pois o sistema perdeu energia. Havia iniciado com 21 e terminou com 13, o que indica uma liberação de 8 kcal.
d)Qual a energia liberada ou absorvida pela reação?
R: Conforme o quesito anterior, ela foi liberada pelo sistema na quantidade de 8 kcal.
|
Fatores que podem afetar a velocidade de uma reação química |
§
Pressão: Quando falamos da influência da pressão na velocidade de uma reação, devemos pensar somente nos reagentes gasosos. Se aumentarmos a pressão (diminuindo o volume, por exemplo), aumentamos o número de colisões e, portanto, a velocidade. Note que aumentar a pressão equivale a aumentar a concentração dos participantes gasosos, o que também explica o aumento da velocidade da reação.Evidentemente, como se trata de uma mistura (substâncias reagentes), estamos nos referindo, para cada participante, à sua pressão parcial, que pode ser dada pela equação de Clapeyron (PV=nRT).
Um exemplo simples que mostra a influência da pressão na velocidade de uma reação é o que ocorre na panela de pressão. Aumentando a pressão, haverá um aumento na temperatura de ebulição da água dentro da panela, possibilitando assim um cozimento mais rápido do alimento imerso.
§
Concentração dos reagentes: Geralmente quanto mais concentrado mais rápido é a velocidade. Existem exceções a esta regra. Para exemplificar, podemos utilizar um experimento simples, que é mergulhar pedaços iguais de um metal adequado em soluções aquosas de um ácido em diferentes concentrações e observar o desprendimento de gás hidrogênio. Quanto mais concentrada for a solução do ácido, maior será a quantidade de hidrogênio liberada no mesmo intervalo de tempo, gerando assim uma velocidade maior.
§
Temperatura: Normalmente a velocidade das reações aumenta com o aumento da temperatura. Um aumento de 10oC chega a dobrar a velocidade de uma reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas, ou seja, aumentar a velocidade das moléculas. É fácil perceber que moléculas mais rápidas colidem com mais freqüência e com mais violência. Logo, mais moléculas reagem em certo intervalo de tempo e com isso, a velocidade aumenta.Exemplificar isso no cotidiano é observar o refrigerador onde a velocidade de decomposição de alimentos por microorganismos é diminuída pela diminuição da temperatura.
§
Estado físico dos reagentes. Normalmente a velocidade segue esta ordem: gases >soluções > líquidos puros > sólidos. Devido ao aumento da superfície específica;
§
Presença (concentração e forma física) de um catalisador:
Catalisador: espécie química que acelera a velocidade de uma reação química. Os catalisadores atuam reduzindo a energia de ativação, e por conseqüência, aumentando a velocidade.
Inibidor: espécie química que, juntamente com as moléculas reagentes, faz com que estas reajam a uma velocidade menor. São utilizados como conservantes de alimentos, pois eles retardam a reação de decomposição. Por exemplo, podemos citar na margarina, a ação do conservante EDTA cálcico dissódico.
Ativador ou promotor: espécie química que, juntamente com o catalisador e as moléculas reagentes, faz com que estas reajam a uma velocidade ainda maior do que se estivessem apenas com o catalisador.
Veneno: espécie química que, juntamente com o catalisador e as moléculas reagentes, faz com que estas reajam a uma velocidade menor do que se estivessem apenas com o catalisador.
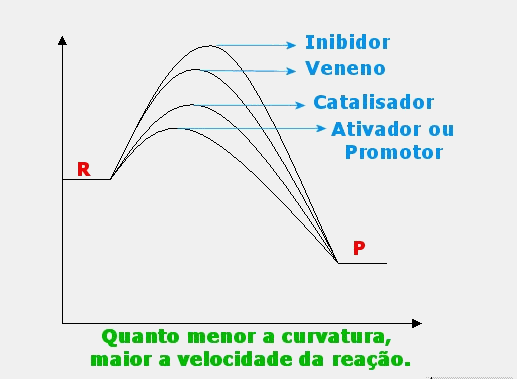
§
Luz. A presença de luz de certo comprimento de onda também pode acelerar certas reações químicas.Para determinar a velocidade instantânea de uma reação, utilizamos uma lei enunciada pelos cientistas noruegueses Maximilian Guldberg e Peter Waage, em 1864, a Lei da ação das massas: "A velocidade de uma reação, em dado instante e a cada temperatura, é proporcional ao produto das concentrações em quantidade de matéria dos reagentes, elevadas a potências iguais aos respectivos coeficientes na equação química balanceada". Veja:
Constante da velocidade é denominada de k. É uma constante de proporcionalidade que relaciona velocidade e concentração. Tem valor constante a uma temperatura e varia com a temperatura. Para dada reação, a constante de velocidade depende fundamentalmente da temperatura, isto é, variando a temperatura, varia o valor de k.
Quando um dos reagentes se encontra no estado sólido, ou líquido em excesso, sua concentração não aparece na equação da Lei da ação das massas:
Os expoentes a e b na expressão de cálculo da velocidade instantânea, na verdade, são determinados experimentalmente. Existem reações que ocorrem em várias etapas, e a mais lenta determina a velocidade da reação. Por exemplo:
Assim, os expoentes serão iguais aos coeficientes da equação balanceada somente para reações elementares, que ocorrem em uma única etapa.
A ordem de uma reação é dada pela soma dos expoentes aos quais estão elevadas as concentrações na fórmula da velocidade:
A molecularidade de uma reação é o número de moléculas que se chocam em cada etapa da reação e é dada pela soma dos coeficientes estequiométricos dos reagentes: