

A reação de hidrólise, tanto do cátion como do anion, constitui um sistema dm equilíbrio, de modo que podemos aplicar a lei da ação das massas (Lei de Guldberg-Waage).
A constante de hidrólise pode ser expressa em função da constante de ionização do respectivo ácido ou base fraco.
v
Hidrólise do cátion: suponha uma solução em que ocorra somente a hidrólise do cátion NH4+ :
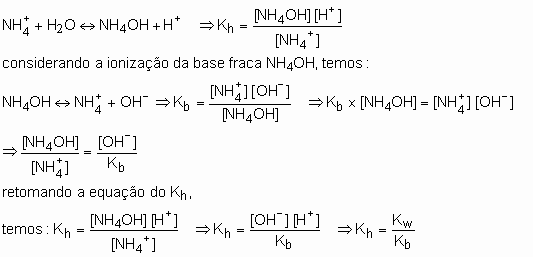
A constante de hidrólise de um cátion é igual à razão
entre o produto iônico da água e a constante de ionização da base
correspondente. ![]()
v
Hidrólise do ânion: A constante de hidrólise de um ânion é igual à razão entre o produto iônico da água e a constante de ionização do ácido correspondente.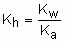
v
Hidrólise do cátion e do ânion: A constante de hidrólise conjunta de cátion e ânion é igual à razão entre o produto iônico da água e o produto das constantes de ionização do ácido e da base correspondente.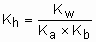
1. Prepara-se uma solução de nitrito de potássio (KNO2), a 20O C. Calcular a constante de hidrólise, sabendo que nessa temperatura a constante de ionização do ácido nitroso é 4,0x10-4. R=2,5x10-11
2. Dissolve-se cloreto de amônio (NH4Cl) em água, a 20O C. Sabendo que nessa temperatura a constante de ionização do hidróxido de amônio é 2,0x10-5, calcule a constante de hidrólise. R=5x10-10
3. Prepara-se uma solução de cianeto de potássio (KCN), a 20O C. Determine a constante de hidrólise, sabendo que a constante de ionização do ácido cianídrico é 8,0x10-10, nessa temperatura. R=1,25x10-5
4. Calcule a constante de hidrólise do acetato de amônio (NH4Ac), sabendo que as constantes de ionização do ácido acético e do hidróxido de amônio são 2x10-5, na temperatura considerada. R=2,5x10-5