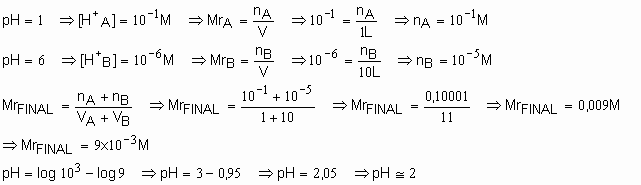Solubilidade em água:
a solubilidade de uma material em água é a quantidade máxima desse material que se dissolve numa quantidade padrão de água, numa determinada temperatura. Por exemplo, a solubilidade do cloreto de prata (AgCl) é de 1,6x10-3 g/L, a 20O C. Isso significa que se dissolvem no máximo 1,6x10-3 g de cloreto de prata em 1 litro de água, a 20O C. Podemos transformar isso em concentração molar, aplicando a fórmula C=Mr. M1.A solubilidade do cloreto de prata , a 20O C,
é de 1,6x10-3 g/L. Determinar a solubilidade desse sal, em mg/L
e mol/L, nessa mesma temperatura.
R=1,6mg/L e 1,11x10-5 M
A solubilidade do hidróxido de magnésio – Mg(OH)2
é de 1,16x10-2 g/L. Determinar as concentrações molares dos
íons Mg+2 e OH- numa solução saturada desse
composto.
R=[Mg+2]=2x10-4 M e [OH-]=4x10-4 M
Calcule as solubilidades em mg/L, mol/L e g/L, considerando as solubilidades fornecidas dos compostos:
a)Cromato de prata - Ag2CrO4 - 2,5x10-2
g/L –
R= 25 mg/L e
7,5x10-5 M
b)Sulfeto de prata - Ag2S - 3,5x10-17 M –
R= 8,6x10-15
g/L e 8,6x10-12 mg/L
c)ortofosfato plumboso - Pb3(PO4)2 - 1,2x10-4
g/L –
R= 0,12 mg/L
e 1,5x10-7 M
d)sulfato de prata - Ag2SO4 - 2,57x10-2 M –
R= 8 g/L e
8,0x10-3 mg/L
e) hidróxido de magnésio - Mg(OH)2 - 1,16x10-2 g/L –
R= 11,6 mg/L
e 2,0x10-4 M
f)sulfato de cálcio - CaSO4 - 1,47x10-2 M –
R= 2 g/L e
2,0x10-3 mg/L
Sabendo que a solubilidade do hidróxido férrico – Fe(OH)3
– é de 4,65x10-8 g/L, calcule as concentrações molares dos
íons Fe+3 e OH- existentes numa solução saturada
desse hidróxido.
R= 4,3x10-10 M e 1,3x10-9 M
Calcule as concentrações molares dos íons prata e fosfato, numa solução saturada de ortofosfato de prata – Ag3PO4, cuja solubilidade é de 6,7x10-3 g/L. R= 4,8x10-5 M; 1,6x10-5 M.
Produto de solubilidade:
Experimentalmente, descobriu-se que, em uma solução saturada, a certa temperatura, de um eletrólito pouco solúvel, é constante o produto das concentrações molares dos íons, elevadas a potencias correspondentes aos coeficientes desses íons na equação química de dissociação. Essa constante recebe o nome de constante de solubilidade (Ks) ou produto de solubilidade (PS).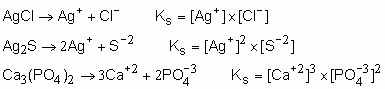
Escreva a expressão da constante de solubilidade dos seguintes compostos
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
38. Sabendo que a solubilidade do cromato de prata – Ag2CrO4 – é de 2,5x10-2 g/L, a determinada temperatura, calcular o seu produto de solubilidade nessa temperatura. R=1,7x10-12M

39. Calcule o Ks do fosfato de prata – Ag3PO4, sabendo que a sua solubilidade é de 6,5x10-3 g/L. R=1,59x10-18
40. A solubilidade do fosfato de chumbo II – Pb3(PO4)2 – é de 1,4x10-4 g/L. Determine o Ks desse sal. R:1,62x10-32
41. Determine o produto de solubilidade do cloreto de chumbo II – PbCl2 – cuja solubilidade é de 11g/L. R=2,37x10-4
42. A solubilidade do hidróxido férrico – Fe(OH)3 – em uma determinada temperatura é de 4,82x10-8 g/L. Determine o seu produto de solubilidade nessa temperatura. R=1,1x10-36
43. A solubilidade do carbonato de bário – BaCO3 – é de 1,3x10-2M. Descubra o produto de solubilidade desse sal. R=1,69x10-4
44. Prepara-se um litro de uma solução saturada de cloreto de prata – AgCl . Calcule a constante de solubilidade, sabendo que foi dissolvido 1,7x10-3g desse sal. R=1,4x10-10
45. Determinar a solubilidade (em mol/L) do sulfeto de prata (Ag2S) a certa temperatura, sabendo que o produto de solubilidade nessa temperatura é 1,6x10-48. R=7,4x10-17M
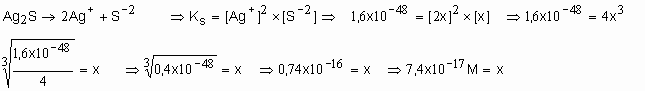
46. Sabe-se que o Ks do fosfato de prata – Ag3PO4 , a 25O C, é 1,56x10-48. Determine a solubilidade do sal nessa temperatura. R=4,8x10-13
47. Calcule a solubilidade em água, a 18O C, do sulfeto férrico – Fe2S3 – sabendo que nessa temperatura o seu produto de solubilidade é 3,456x10-52. R=2x10-11
48. O produto de solubilidade, a 20O C, do hidróxido férrico – Fe(OH)3 – é 1,16x10-16. Descubra a solubilidade, a 20O C, em g/L , dessa base. R=4,8x10-3 g/L
49. Calcule a solubilidade do sulfeto de manganês II – MnS – em g/L, sabendo que o seu produto de solubilidade é 2x10-15 . R=3,88x10-6
50. Descubra a massa de sulfeto de ferro II – FeS – necessária para que sejam preparados 500 mL de solução saturada desse sal, sabendo que o seu produto de solubilidade é 4x10-19. R=2,78x10-8
51. Quantos gramas de sulfato de bário – BaSO4 – são necessários para preparar um litro de solução saturada, sabendo que o produto de solubilidade desse sal é 1,1x10-10? R=2,44x10-3
52. A dose letal de íons Ba+2 para o ser humano é de 2x10-3 mol de íons Ba+2 por litro de sangue. Para se submeter a um exame de raios-X, um paciente ingeriu 200 mL de uma suspensão de sulfato de bário – BaSO4 . Supondo-se que os íons Ba+2 solubilizados na suspensão foram integralmente absorvidos pelo organismo e dissolvidos em 5 litros de sangue, discuta se essa dose coloca em risco a vida do paciente, considerando que o produto de solubilidade do sulfato de bário é igual a 1x10-10 M. R=Não coloca em risco, pois [Ba+2]=4x10-7M
53. Em um béquer foram misturadas soluções aquosas de cloreto de potássio, sulfato de sódio e nitrato de prata, ocorrendo, então, a formação de um precipitado branco, que se depositou no fundo de um béquer. A análise da solução sobrenadante revelou as seguintes concentrações: [Ag+]=1,0x10-3M; [SO4-2]=1,0X10-1M e [Cl-]=1,6X10-7M. De que é constituído o sólido formado? Justifique com cálculos.
|
Composto |
Produto de solubilidade |
Cor |
|
|
Dados |
Cloreto de prata – AgCl |
1,6X10-10 |
Branca |
|
Sulfato de prata – Ag2SO4 |
1,4X10-5 |
Branca |
Note que para o sulfato de prata , o Ks não é alcançado (1,4x10-5), indicando que a presença de íons Ag+ e Cl- é a máxima possível na solução. Então, se houver formação de precipitado, este será de cloreto de prata.
54. Uma solução saturada de base, representada por X(OH)2, tem pH=10 a 25O C. Qual o produto de solubilidade do X(OH)2?
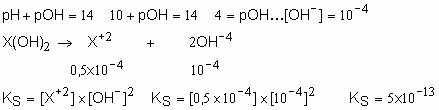
Solução tampão
: são soluções que mantêm o pH aproximadamente constante, mesmo recebendo ácidos ou bases fortes. As soluções tampão são geralmente formadas por um ácido fraco e um sal desse ácido, ou, então, por uma base fraca e um sal dessa base. As soluções tampão são usadas sempre que um químico necessita de um meio com pH aproximadamente constante. Elas são preparadas dissolvendo-se os solutos em água.Veja os exemplos:Solução de ácido acético (H3CCOOH) e acetato de sódio (H3CCOONa): o sal sofre dissociação total em íons Na+ e H3CCOO-. Devido ao efeito do íon comum (H3CCOO-), o ácido, que já é fraco, sofre um deslocamento no sentido das moléculas não ionizadas. Observe: H3CCOONa è Na+ + H3CCOO-
H3CCOOH è H+ + H3CCOO-
Note que a solução terá bastante íons Na+ + H3CCOO- e bastante moléculas H3CCOOH não ionizadas. Agora, veja porque o pH dessa solução não varia:
v
Se adicionássemos a essa solução HCl, por exemplo, o pH deveria diminuir, pois o HCl libera muitos íons H+. Entretanto, esses íons H+ são retirados da solução pelos íons H3CCOO- , formando moléculas não ionizadas H3CCOOH; com isso, o pH da solução se mantém.v
Se adicionássemos a essa solução NaOH, por exemplo, o pH deveria aumentar, pois o NaOH libera muitos íons OH-. No entanto, esses íons são retirados da solução pelas moléculas não ionizadas de H3CCOOH, mantendo-se, assim, o pH da solução. H3CCOOH + OH- è H2O + H3CCOO-Podemos ter outras soluções tampão: Solução de hidróxido de amônio e cloreto de amônio; solução de ácido carbônico e bicarbonato de sódio.
Para calcular o pH de uma solução tampão, utilizamos a fórmula adequada para a solução. Veja:
![]() para tampões ácido/sal e
para tampões ácido/sal e ![]() para tampões base/sal
para tampões base/sal
55. Descobrir o pH de uma solução tampão formada por ácido acético 0,01M e acetato de sódio também 0,01M. Dado: Ka=2x10-5
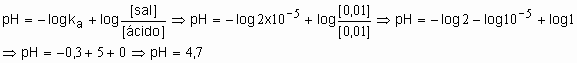
56. Calcular o pH de uma solução tampão formada por hidróxido de amônio 0,1M e cloreto de amônio 0,02M.
Dado: Kb=2x10-5
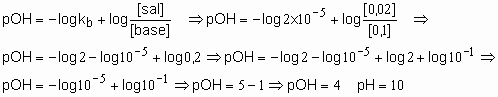
57. Em estudos ligados à medicina e à biologia é muito importante o conceito de solução tampão, pois os fluidos biológicos (animais ou vegetais) são, em geral, meios aquosos tamponados. Diga quais dentre os seguintes pares de substancias, quando em solução aquosa, produzem uma solução tampão. Explique o critério que você usou na escolha:
I. HCl + NaOH
II. NaOH + NaCl
III. NaCN + HCN
IV. NH4Cl + NH4OH
V. CH3COOH + CH3COONa
58. Determine o pH de uma solução tampão constituída por ácido acético 0,1M e acetato de sódio 0,01M.
Dado: Ka=2x10-5 log 2=0,3 log 5=0,7 R=3,7
59. Calcule o pH de uma solução tampão formada por hidróxido de amônio 0,2M e cloreto de amônio 0,02M.
Dado: Kb=2x10-5 log 2=0,3 log 5=0,7 R=10,3
60. Descubra o pH de uma solução tampão formada por ácido carbônico 0,5M e bicarbonato de sódio 0,05M.
Dado: Ka=5x10-7 log 2=0,3 log 5=0,7 R=5,3
61. Determine o pH de uma solução formada, juntando 1 litro de uma solução aquosa de ácido clorídrico com pH=1 a 10,0 litros de uma solução aquosa de ácido clorídrico com pH=6. Dado: Log 9 = 0,95