

Definição: são compostos binários nos quais o oxigênio é o elemento mais eletronegativo.
Fórmula Geral: E+y O2- => E2Oy
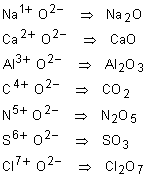
Sendo possível, devemos simplificar os índices, conforme o exemplo acima.
Classificação dos óxidos
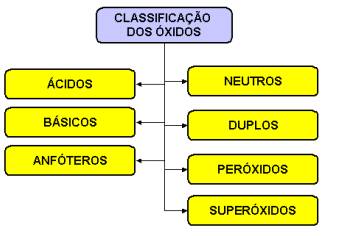
óxidos
ácidos: São óxidos que reagem com a água produzindo um ácido, ou reagem com
uma base produzindo sal e água.
São formados por ametais (e, nesse caso, são compostos geralmente gasosos) ou por metais com número de oxidação elevados (+5, +6 ou +7). São compostos moleculares e, em geral, solúveis em água.
Podemos considerar um óxido ácido como um "ácido sem água". Daí o nome anidrido dado a esses óxidos (do grego anhydros, "sem água").
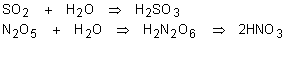
Para reagir o óxido ácido com a base, produzindo o sal e água, devemos encontrar primeiro o ácido formado pelo óxido e somente depois juntar com a base. Veja os exemplos:
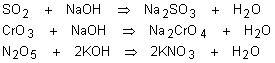
Podemos criar uma regra prática para encontrar o anidrido que corresponde a cada ácido, a partir da fórmula do composto covalente que dá origem a esse ácido. Vejamos:
***Composto que possui número par de hidrogênios: basta tirar da fórmula tantas moléculas de água quantas permitir o número de hidrogênios (de modo a eliminar os hidrogênios da fórmula)
![]()
***Composto que possui número ímpar de hidrogênios: devemos multiplicar por dois a fórmula do composto covalente que dá origem ao ácido para tornar o número de hidrogênios e depois agir como na regra anterior.
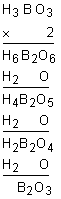
óxidos
básicos: São óxidos que reagem com a água produzindo uma base, ou reagem com
um ácido produzindo sal e água.
São formados por metais com número de oxidação baixo (+1, +2 ou +3). São compostos sólidos, iônicos, que encerram o ânion oxigênio (O2-), e apresentam pontos de fusão e de ebulição elevados. Os óxidos dos metais alcalinos e alcalino-terrosos reagem com a água; os demais óxidos básicos são pouco solúveis em água.
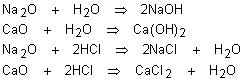
óxidos
anfóteros: São óxidos que podem se comportar ora como óxido básico, ora
como óxido ácido.
Sendo "indecisos" entre o caráter básico e o caráter ácido, os óxidos anfóteros só reagem com outra substância de caráter químico pronunciado: ou ácido forte ou base forte.
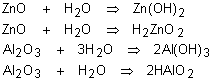
Os óxidos anfóteros são, em geral, sólidos, moleculares, insolúveis em água e formados:

Quando um metal forma vários óxidos, é interessante notar que o caráter do óxido passa, gradativamente, de básico para anfótero e depois para ácido, à medida que o número de oxidação vai crescendo. Veja o exemplo a seguir:
CrO (básico) Cr2O3 (anfótero) CrO3 (ácido)
óxidos
neutros ou indiferentes: São óxidos que não reagem nem com água, nem com
ácidos, nem com bases.
Assim, os óxidos neutros não apresentam nem caráter ácido nem caráter básico. São poucos os óxidos dessa classe.
Os mais comuns são: CO, NO e N2O.
São compostos gasosos, moleculares formados por ametais. Mas o fato de serem "indiferentes"ou "neutros" não significa que esses óxidos não possam participar de outras reações. O monóxido de carbono, por exemplo, queima com muita facilidade.
![]()
óxidos
duplos, mistos ou salinos: São óxidos que se comportam como se fossem formados
por dois outros óxidos, do mesmo elemento químico.
![]()
São sempre óxidos metálicos, sólidos e de estrutura iônica. Eles reagem como se fossem mistura de dois óxidos.
![]()
Peróxidos:
São óxidos que reagem com a água ou com ácidos diluídos produzindo água
oxigenada (ou peróxido de hidrogênio - H2O2). O
oxigênio apresenta número de oxidação -1.
![]()
Reagem com ácidos, produzindo sal e água oxigenada.
![]()
A nomenclatura é feita com a própria palavra peróxido. Por exemplo:
H2O2 : peróxido de hidrogênio;
Na2O2 : peróxido de sódio;
CaO2 : peróxido de cálcio;
Superóxidos:
São óxidos que reagem com a água ou com ácidos diluídos produzindo água
oxigenada (ou peróxido de hidrogênio - H2O2) e liberando
gás oxigênio (O2). O oxigênio apresenta número de oxidação -1/2.
![]()
![]()
São sólidos iônicos, formados pelos cátions alcalinos ou alcalino-terrosos.
A nomenclatura é feita com a própria palavra superóxido. Por exemplo:
NaO2 : superóxido de sódio;
CaO4 : superóxido de cálcio;
Alguns exercícios resolvidos
Coloque os óxidos MnO3, Mn2O3, MnO2, Mn2O7 e MnO na ordem do mais básico para o mais ácido.
Resolução: Basta calcular o número de oxidação de cada Mn e lembrar que quanto menor ele for, mais básico ele será. Dessa forma, teremos a seguinte ordem:
MnO, Mn2O3, MnO2, MnO3 e Mn2O7
(Unirio)
Uma forma genérica de se obterem ácidos é a reação entre seu anidrido e
água. Entre os ácidos abaixo relacionados, não pode ser obtido por esse
processo o:
a)hipocloroso
b)cloroso
c)clórico
d)perclórico
e)clorídrico
Resolução:
Letra E, pois ele não apresenta oxigênio em sua estrutura
(Fuvest-SP)
Quando aplicada em ferimentos, a água oxigenada parece ferver.
a)Por quê?
b)Escreva a equação que representa a reação química envolvida.
Resolução:
a) Devido a liberação de gás oxigênio (O2) e
b)
![]()
Complete
as reações:
a)MgO + H2O -->
b)CO2 + H2O -->
c)K2O + HCl -->
d)SO3 + NaOH -->
e)N2O5 + H2O -->
f)CO + H2O -->
g)K2O + H2O -->
Qualquer dúvida envie um e-mail para Prof. João Neto