

Reações Químicas
É a transformação de uma ou mais substâncias em novas substâncias. As iniciais são destruídas e originam novos tipos de substâncias, ocorrendo, assim, mudanças nos tipos de moléculas. Todo fenômeno químico é uma reação química.
Os reagentes são as substâncias iniciais, ou seja, que sofrem o fenômeno químico. Os reagentes são consumidos durante o processo de transformação.
Os produtos são as substâncias finais, ou seja, são formadas no lugar dos reagentes (que desaparecem). São o resultado da transformação química ocorrida.
![]()
Equação química é a representação gráfica das reações químicas utilizando fórmulas químicas. Nelas, os reagentes são colocados à esquerda (1º membro) e os produtos à direita (2º membro). Entre ambos utiliza-se uma seta, orientada dos reagentes para os produtos. Os números que precedem as fórmulas das substâncias recebem o nome de coeficientes estequiométricos e indicam a proporção entre o número de moléculas reagentes e produzidas.
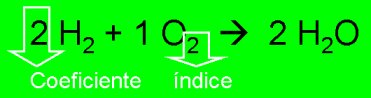
Observando o exemplo acima, podemos ver:
O elemento hidrogênio (H) e o elemento oxigênio participam da reação através das substâncias simples H2 e O2. São duas moléculas de H2 para uma molécula de O2. Durante o processo serão consumidas, formando uma substância composta (H2O), que estará presente com duas moléculas.
Os coeficientes são necessários para o balanceamento da equação, ou seja, para que se iguale o número de átomos de cada elemento em ambos os membros da equação química. Voltando ao exemplo acima, observe que teremos:
4
átomos de hidrogênio no primeiro e segundo membros da equação;
2
átomos de oxigênio no primeiro e segundo membros da equação.
Veja que ocorreu uma rearranjo de átomos:
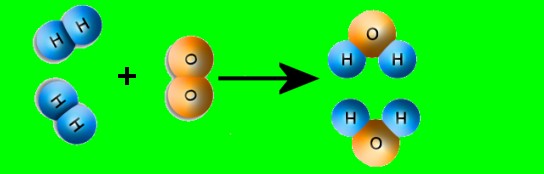
Para que ocorra uma reação química, é preciso desfazer as moléculas dos reagentes (H2 e O2) e dispor seus átomos segundo uma nova recombinação. Ocorrerá a formação de novos tipos de moléculas (H2O) e, conseqüentemente, de novas substâncias. No exemplo acima, veja que as substâncias simples (H2 e O2) separaram, formando uma substância composta (H2O).
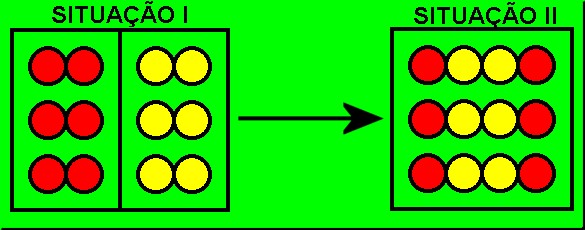
Veja que os reagentes (situação I) eram substâncias simples (formadas por um só tipo de elemento químico) e passaram a ser substâncias compostas (situação II), o que caracteriza que foram modificados, ocorrendo uma reação química.
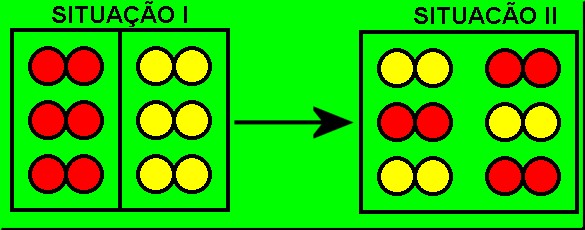
Veja que os reagentes (situação I) eram substâncias simples (formadas por um só tipo de elemento químico) e continuam sendo, pois estão apenas misturadas (permanecem intactas utilizando todo o ambiente).
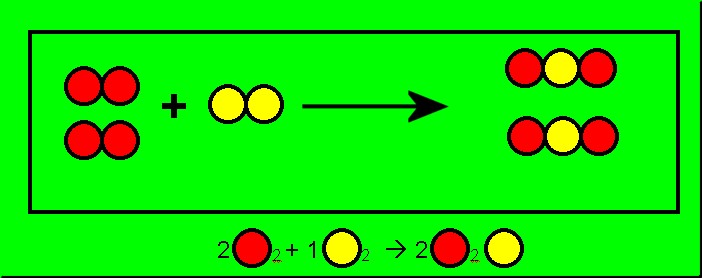
Representamos os elementos, utilizando o modelo de bolas, para demonstrar a equação química. Veja como fica mais fácil trabalhar com a segunda representação.
Classificação de reações químicas
Síntese
ou adição: Temos mais de um reagente e só um produto. Genericamente,
podemos afirmar que: A + B à
AB
Ex: N2 + 3H2 à 2NH3
Análise
ou decomposição: Temos apenas um reagente e vários produtos.
Genericamente, podemos afirmar que: AB à
A + B
Ex: CaCO3 à CaO + CO2
Simples
troca ou deslocamento: Temos a mesma quantidade de reagentes e produtos. O
que diferencia é uma substância simples aparece tanto nos reagentes como nos
produtos. Genericamente, podemos afirmar que:
AB + C à AC + B ou AB + C à CB + A
Ex: Fe + HCl à FeCl2 + H2
Dupla
troca ou dupla substituição: Temos
a mesma quantidade de reagentes e produtos. O que diferencia é que todos são
substâncias compostas tanto nos reagentes como nos produtos. Genericamente,
podemos afirmar que:
AB + CD à AD + CB
Ex: HCl + NaOH à NaCl + H2O
Balanceamento pelo método direto ou por tentativas
Balanceamento pelo método de oxiredução
Qualquer dúvida com relação à teoria, envie um e-mail para Prof. João Neto